Europium, het symbool is Eu, en het atoomnummer is 63. Als typisch lid van de lanthanidengroep heeft europium gewoonlijk een valentie van +3, maar een zuurstofvalentie van +2 komt ook vaak voor. Er zijn minder europiumverbindingen met een valentie van +2. Vergeleken met andere zware metalen heeft europium geen significante biologische effecten en is het relatief niet-toxisch. De meeste toepassingen van europium maken gebruik van het fosforescentie-effect van europiumverbindingen. Europium is een van de minst voorkomende elementen in het heelal; er zijn er slechts ongeveer 5 in het heelal × 10-8% van de stof is europium.
Europium komt voor in monaziet
De ontdekking van Europium
Het verhaal begint aan het einde van de 19e eeuw: in die tijd begonnen excellente wetenschappers systematisch de resterende gaten in Mendelejevs periodiek systeem te vullen door het atomaire emissiespectrum te analyseren. Tegenwoordig is deze taak niet moeilijk en kan een student hem volbrengen; maar in die tijd beschikten wetenschappers slechts over instrumenten met een lage precisie en monsters die moeilijk te zuiveren waren. Daarom bleven alle "quasi"-ontdekkers in de hele geschiedenis van de ontdekking van lanthanide valse beweringen doen en met elkaar discussiëren.
In 1885 ontdekte Sir William Crookes het eerste, maar niet erg duidelijke signaal van element 63: hij observeerde een specifieke rode spectraallijn (609 nm) in een samariummonster. Tussen 1892 en 1893 bevestigde de ontdekker van gallium, samarium en dysprosium, Paul émile LeCoq de Boisbaudran, deze band en ontdekte hij een andere groene band (535 nm).
Vervolgens, in 1896, scheidde Eugène Anatole Demarç geduldig samariumoxide en bevestigde de ontdekking van een nieuw zeldzaam aardelement, gelegen tussen samarium en gadolinium. Hij scheidde dit element met succes in 1901, waarmee de ontdekkingsreis ten einde kwam: "Ik hoop dit nieuwe element Europium te noemen, met het symbool Eu en een atomaire massa van ongeveer 151."
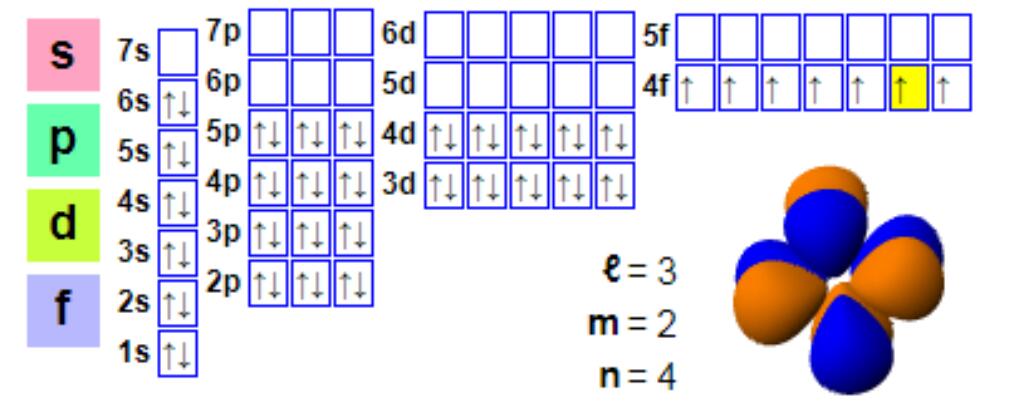
Elektronenconfiguratie
Elektronenconfiguratie:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f7
Hoewel europium doorgaans driewaardig is, is het vatbaar voor de vorming van tweewaardige verbindingen. Dit fenomeen verschilt van de vorming van +3-valentieverbindingen door de meeste lanthaniden. Tweewaardig europium heeft een elektronenconfiguratie van 4f7, omdat de halfgevulde f-schil meer stabiliteit biedt, en europium (II) en barium (II) zijn vergelijkbaar. Tweewaardig europium is een mild reductiemiddel dat in de lucht oxideert tot een verbinding van europium (III). Onder anaërobe omstandigheden, met name verhittingsomstandigheden, is tweewaardig europium voldoende stabiel en heeft het de neiging om te worden opgenomen in calcium en andere aardalkalimineralen. Dit ionenuitwisselingsproces vormt de basis van de "negatieve europiumanomalie", dat wil zeggen, vergeleken met de overvloed van chondriet, hebben veel lanthanidemineralen zoals monaziet een laag europiumgehalte. Vergeleken met monaziet vertoont bastnaesiet vaak minder negatieve europiumanomalieën, dus bastnaesiet is ook de belangrijkste bron van europium.
Europium is een ijzergrijs metaal met een smeltpunt van 822 °C, een kookpunt van 1597 °C en een dichtheid van 5,2434 g/cm³. Het is het minst dichte, zachtste en meest vluchtige element onder de zeldzame aardmetalen. Europium is het meest actieve metaal onder de zeldzame aardmetalen: bij kamertemperatuur verliest het in de lucht onmiddellijk zijn metaalglans en oxideert het snel tot poeder. Het reageert heftig met koud water, waarbij waterstofgas ontstaat. Europium kan reageren met boor, koolstof, zwavel, fosfor, waterstof, stikstof, enz.
Toepassing van Europium
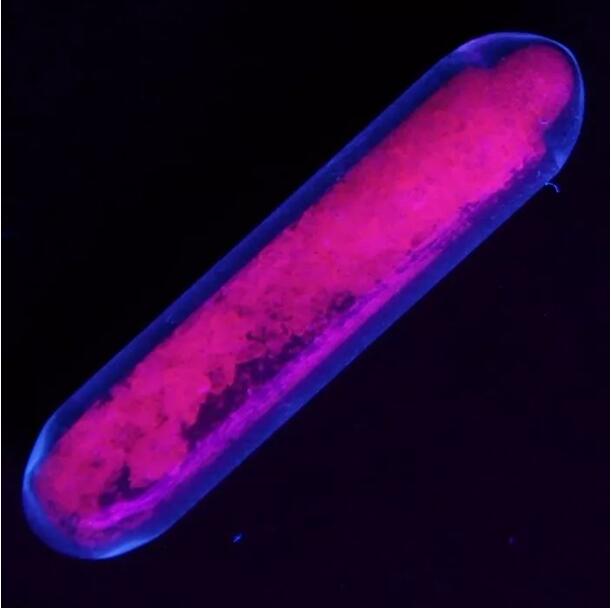
Europiumsulfaat zendt rode fluorescentie uit onder ultraviolet licht
Georges Urbain, een jonge, vooraanstaande chemicus, erfde het spectroscopie-instrument van Demarçay en ontdekte dat een monster van yttrium(III)oxide gedoteerd met europium in 1906 zeer helder rood licht uitzond. Dit is het begin van de lange reis van fosforescerende materialen op basis van europium – niet alleen gebruikt om rood licht uit te zenden, maar ook blauw licht, omdat het emissiespectrum van Eu2+ binnen dit bereik valt.
Een fosfor bestaande uit rode Eu3+-, groene Tb3+- en blauwe Eu2+-emitters, of een combinatie daarvan, kan ultraviolet licht omzetten in zichtbaar licht. Deze materialen spelen een belangrijke rol in diverse instrumenten wereldwijd: röntgenversterkende schermen, kathodestraalbuizen of plasmaschermen, evenals recente energiezuinige fluorescentielampen en lichtgevende diodes.
Het fluorescentie-effect van driewaardig europium kan ook worden gesensibiliseerd door organische aromatische moleculen. Dergelijke complexen kunnen worden toegepast in verschillende situaties waarbij een hoge gevoeligheid vereist is, zoals anti-namaakinkt en streepjescodes.
Sinds de jaren 80 speelt europium een leidende rol in zeer gevoelige biofarmaceutische analyses met behulp van de tijdsafhankelijke koudefluorescentiemethode. In de meeste ziekenhuizen en medische laboratoria is dergelijke analyse routine geworden. In het onderzoek in de levenswetenschappen, waaronder biologische beeldvorming, zijn fluorescerende biologische probes van europium en andere lanthaniden alomtegenwoordig. Gelukkig is één kilo europium voldoende voor ongeveer een miljard analyses – nadat de Chinese overheid onlangs de export van zeldzame aardmetalen heeft beperkt, hoeven geïndustrialiseerde landen, die in paniek raken door tekorten in de opslag van zeldzame aardmetalen, zich geen zorgen te maken over soortgelijke bedreigingen voor dergelijke toepassingen.
Europiumoxide wordt gebruikt als gestimuleerde emissiefosfor in nieuwe medische röntgendiagnosesystemen. Europiumoxide kan ook worden gebruikt voor de productie van gekleurde lenzen en opto-elektronische filters, voor magnetische bubbelopslagapparaten en in regelmaterialen, afschermingsmaterialen en structurele materialen van atoomreactoren. Omdat de atomen ervan meer neutronen kunnen absorberen dan enig ander element, wordt het vaak gebruikt als materiaal voor de absorptie van neutronen in atoomreactoren.
In de snelgroeiende wereld van vandaag kan de recent ontdekte toepassing van europium grote gevolgen hebben voor de landbouw. Wetenschappers hebben ontdekt dat kunststoffen gedoteerd met tweewaardig europium en éénwaardig koper het ultraviolette deel van zonlicht efficiënt kunnen omzetten in zichtbaar licht. Dit proces is vrij groen (het is de complementaire kleur van rood). Door dit type plastic te gebruiken voor de bouw van een kas, kunnen planten meer zichtbaar licht absorberen en de oogstopbrengst met ongeveer 10% verhogen.
Europium kan ook worden toegepast in quantumgeheugenchips, die informatie betrouwbaar meerdere dagen achter elkaar kunnen opslaan. Hiermee kunnen gevoelige quantumgegevens worden opgeslagen in een apparaat dat vergelijkbaar is met een harde schijf en door het hele land worden verzonden.
Plaatsingstijd: 27 juni 2023